化学计算过程,主如果一个化学问题的数学处置过程,即对物质的组成、结构、性质和变化规律的量化过程。它以基本定义、基本理论、元素化合物常识为基础,以物质的量为中心,以量方程、化学式、化学方程式及溶液组成常识为定量工具,理解和运用化学定义、化学原理,进行对比、判断、推理,这是化学计算的思维过程。因此化学计算是高考考试考试试题和化学复习中的五大块之一,分基本定义、入门知识,解题的基本办法和方法,科学的思维剖析办法和综合解题能力三个层次。 1、近年高考考试计算题变化 近几年高考考试化学计算题的变化是困难程度有所减少,愈加突出了化学计算的特征,与生产、科学研究的实质比较贴近。依据历届高考考试考试试题中的考试知识点显示,化学计算的考查主要包含元素的水平分数、分子式与相对原子水平和相对分子水平、溶解度、水平分数、物质的量浓度、溶液的pH值、有关化学平衡、多步反应、有关混合物、依据化学方程式计算及综合计算等十一个方面的计算。近几年的化学高考考试题对计算的方法和办法(差量法、十字交叉法、估算法、等效转换法、守恒法、讨论法、极端假设法等)的考查需要有所减少,对思维逻辑性、敏捷性、发散性和创造性与有关学科常识的运用能力有深刻的考查。 2、对教学与复习的建议 ㈠统揽全局,合理安排 在第一轮化学复习教学中需要纵览全局,注意各章节计算内容的合理渗透,按部就班打好扎实的计算基础。各章节常识内容及办法见表2。
常识内容容易见到计算常用解题办法初中常识溶质水平分数及溶解度公式法、隔离法、终态剖析法化学反应及其能量变化燃烧热、中和热的计算,氧化还原反应的有关计算关系式法、电子转移守恒法碱金属有关Na,Na2O2,NaHCO3,Na2CO3的计算差量法、极端剖析法、不等式法、讨论法物质的量物质的量、水平、气体体积、微粒数、物质的量浓度、水平分数公式法卤素卤素间的置换反应、过量问题计算差量法、分段讨论法、数轴法、关系式法物质结构元素周期律相对原子水平、水平数质子数、中子数、电子数、最外层电子数电子层数、核电荷数、原子序数、周期数族序数、晶体结构十字交叉法、公式法、占有比率法硫硫酸有关二氧化硫、硫酸在溶液中反应的计算关系式法碳族元素碳硅及其化合物的计算区间讨论法氮族氮及其化合物的计算、磷及其化合物的计算讨论法、关系式法几种要紧的金属金属与酸反应的计算、铝及其化合物的计算、无机混合物计算、铁及其化合物的计算电子守恒法、元素组成守恒法、讨论法、图象法、图示剖析法、关系式法、有机化学有机物燃烧的计算、有机混合物的计算最间式法、通式法、差量法、不定方程讨论法、平均分子量法、平均组成法化学反应速率化学平衡化学反应速率的计算、有关化学平衡的计算差量法、比率法、水平守恒法、等效转换法电解质溶液有关溶液混合后pH值及离子浓度的计算、电化学及氧化还原的计算公式法、平衡计算法、电荷守恒法、原子守恒法、电子转移守恒法(二)专题练习,提升效益 1、准确、熟练理解有关定义,形成和应用有关常识体系 学会计算定义与化学原理是进行化学计算中思维活动的首要条件,也是化学计算的目的,化学计算的化学味就包含化学定义和原理。理解和运用计算定义、进行判断、推理,这是解题的思维过程。与计算有关的定义和公式又不是孤立的,它们之间存在着相互联系,只有将这类常识分类、交织成网,形成系统,才能完整、准确、灵活地学会、运用它们,假如计算互联网系统在头脑中排列有序,遇见问题便会产生有条有理的联想,再经过筛选、比较、判断、推理,就能形成脉胳通畅的思路。可见,计算定义的准确理解和应用,不止是化学计算的内容,而且是促进常识向能力转化,形成技能方法、进步思维能力的要紧原因。与计算有关的常识体系见下图。
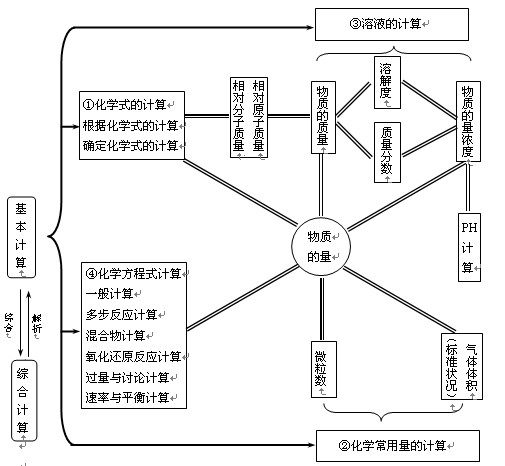 2、总结解题方案与办法 学生对能力性计算题犯难是教学中常见存在的问题,其缘由是除双基不扎实外,更要紧的是没学会解题的方案与办法。常识归类、系统化后,需要对一相同种类型的计算解法进行总结。对解题方案与办法的总结应在解决问题的过程中进行,在问题解决后进一步进行考虑与总结,通过总结提升思维能力。 ⑴求下列物质的实验式: ①某烃含碳元素92.30%(水平分数) ②某有机物含C、H、O三种元素,其水平比为12:3:8 ③完全燃烧3克有机物,生成4.4克CO2和1.8克H2O ⑵求下列物质的相对分子水平 ①某有机物在标准情况下为气态,密度3.488g/L ②某气体200mL(标准情况),其水平为0.572g ③某气体水平是同温同压同体积氢风韵量的15倍 ④某气体密度是同情况空气密度的2倍 ⑶求下列物质的分子式 ①某酯含氢8.1%、含碳48.6%(水平分数),其蒸气的密度是同情况时甲烷密度的4.625倍,求该酯的分子式 ②0℃、91192.5Pa时,将某气态烃200mL和700mL氧气混合,点燃后恰好完全反应,恢复到原条件后,水蒸气凝结为液体,气体总体积为400mL,求该烃的分子式。 ③完全燃烧某烃0.5g,将生成的气体通入足量石灰水中,采集所得沉淀,干燥后称重,测知其水平为原试样水平的7.7倍,又知同体积该化合物蒸气的水平是同头部下空风韵量的2.69倍,求该烃的分子式。[解答]⑴①CH②C2H6O③CH2O⑵①78②64③30④58⑶①C3H60②C2H6③C6H6 通过训练,可总结出实验式、相对分子水平的求法,由实验式、相对分子水平推求分子式的办法,除上述办法外分子式还可以参考物质的通式或化学方程式通式,由有关实验数据计算推导(用示例训练展示)。概括出来的办法,再通过习题练习应用于新问题的解决,使审题快捷,推算浅易。总结容易见到基本题型,学会基本解法,可以提升剖析和解决综合计算题的能力。综合题是是简单题交叉构成的,审题时第一将它分析、分解为几个简单问题,抓住这几个小题的联系进行求解。假如熟知容易见到题型及一般解法,就能比较顺利地考虑剖析,使问题简单化,依据有关信息的相互联系,通过判断、推理得到解决。容易见到的基本题型,比如过量问题,混合物的组成或反应问题,有关化学式计算等等,对其基本解题方案与方法都要在练习中注意小结总结。 3、练习解题思想办法 各层次能力的形成,要点互联网化、基本解法的练习固然非常重要,但在具体问题中,尤其是能力需要高的选择性计算题、综合计算中总是常识的落脚点非常低,考查的是综合思维能力。综合思维能力仍然是在练习中形成的,这种练习是高层次的,不是盲目做很多综合题就能形成的,教师需要立足于培养化学思想办法上选题,使学生有意识在练习中总结形成科学的思维办法,提升学科能力。科学的思想办法来自于事物本身的变化规律。化学变化的实质是原物质的微粒进行拆分,原子重新组合生成新物质的微粒。化学变化是化分化合过程,物质按肯定微粒数比相互反应遵循守恒定律。比率与守恒就是化分化合过程中量的关系,所以分、合、等、比反映了物质化学变化的方法及对立统一关系,是化学计算的基本原理,同时也是解决化学计算问题的思想办法。在具体化学计算中常常要用到的思想办法主要有:察看法、比较法拆分与重组法、建构模型法、分类讨论法、守恒思想、特殊化与一般化思想、平均化与极端化思想、方程思想、函数思想等。这类办法用于解决对应的化学计算,复杂问题简单化了,解题思路方便快捷了,同时这类办法的形成总是又在解题中获得,由于综合性计算题的设计本身就是熔常识与思维于一体的。 CO、HCOOH、OHCCOOH分别完全燃烧、消耗的O2与生成的CO2的体积比都是1:2,后两者的分子式可以看成是CO(H2O)及(CO)2(H2O)也就是说,只须分子式符合[(CO)n(H2O)m](其中n、m为正整数)的各种有机物完全燃烧时消耗的O2与生成的CO2的体积比一直1:2。现有一些只含C、H、O三种元素的有机物,它们完全燃烧时消耗的O2与生成的CO2的体积比是3:4(上述体积均在相同情况下测定)。那样:这类化合物中相对分子水平最小的化合物的分子式是C2H2O2。在这类有机物中有一种化合物含有两个羧基,取0.2625g该化合物恰好跟25.0mL1mol/LNaOH溶液完全中和,由此可知该化合物的相对分子水平为210并可推导出它的分子式应是C6H10O8。 题示信息给出一种通过重组、综合总结、建构模型的思想办法,第一要学习理解这种办法,然后进行应用解决新问题。本题考查学习新信息、新办法并迁移另一情景中进行应用的能力。建构的模型可以反映一类物质或变化的特征。这种办法在科学研究中有要紧意义。在化学计算中,常见的烃的通式CXHY、通式CnH2n+2等事实上也是这类物质组成的一种模型。用这类通式或依据这类通式书写的有关化学方程式进行计算,能使复杂问题简单化,且能帮助认识某些变化规律,培养思维的深刻性、创造性。 化学计算集技能方法、思维练习于一体,熔智商、能力于一炉,能检验学生应用常识的能力层次,对提升学生学习方法,发展学生思维,进步学生智商,提升解题能力非常有帮助。纵览历年来的高考考试,化学计算的困难程度给大家的感觉是不再难算了,这其实是一种错觉。选择性计算题传统巧解性考试试题已经降低,化学原理、定义等化学素材的呈现落脚点减少了,题目看上好像容易了,但思维素质、思维办法的考查需要提升了,所以题目容易做却难得分,加上大部分学生对入门知识的复习看重不够,越简单题越易失分,所以计算题在高考考试中得分仍然较低。所以大家在复习中预防一味讲巧解忽略入门知识、基本计算办法的练习与总结,预防盲目做综合性计算题,一味强调巧解的经验主义做法。做到夯实基础、重视思维品质的培养两头抓实。 3、《考试说明》中化学计算部分 1、学会有关相对原子水平、相对分子水平及确定分子式的计算。 2、学会有关物质的量的计算。 3、学会有关气体摩尔体积的计算。 4、学会有关物质溶解度的计算。 5、学会有关溶液浓度(溶液中溶质的水平分数和物质的量浓度)的计算。 6、学会有关溶液pH与氢离子浓度、氢氧根离子浓度的简单计算。 7、学会有关燃烧热的计算。 8、学会借助化学方程式的计算。 9、以上化学基本定义和基本理论、容易见到元素单质及其要紧化合物、有机化学基础、化学实验等常识内容中,具备化学原因的各类问题的综合应用。
2、总结解题方案与办法 学生对能力性计算题犯难是教学中常见存在的问题,其缘由是除双基不扎实外,更要紧的是没学会解题的方案与办法。常识归类、系统化后,需要对一相同种类型的计算解法进行总结。对解题方案与办法的总结应在解决问题的过程中进行,在问题解决后进一步进行考虑与总结,通过总结提升思维能力。 ⑴求下列物质的实验式: ①某烃含碳元素92.30%(水平分数) ②某有机物含C、H、O三种元素,其水平比为12:3:8 ③完全燃烧3克有机物,生成4.4克CO2和1.8克H2O ⑵求下列物质的相对分子水平 ①某有机物在标准情况下为气态,密度3.488g/L ②某气体200mL(标准情况),其水平为0.572g ③某气体水平是同温同压同体积氢风韵量的15倍 ④某气体密度是同情况空气密度的2倍 ⑶求下列物质的分子式 ①某酯含氢8.1%、含碳48.6%(水平分数),其蒸气的密度是同情况时甲烷密度的4.625倍,求该酯的分子式 ②0℃、91192.5Pa时,将某气态烃200mL和700mL氧气混合,点燃后恰好完全反应,恢复到原条件后,水蒸气凝结为液体,气体总体积为400mL,求该烃的分子式。 ③完全燃烧某烃0.5g,将生成的气体通入足量石灰水中,采集所得沉淀,干燥后称重,测知其水平为原试样水平的7.7倍,又知同体积该化合物蒸气的水平是同头部下空风韵量的2.69倍,求该烃的分子式。[解答]⑴①CH②C2H6O③CH2O⑵①78②64③30④58⑶①C3H60②C2H6③C6H6 通过训练,可总结出实验式、相对分子水平的求法,由实验式、相对分子水平推求分子式的办法,除上述办法外分子式还可以参考物质的通式或化学方程式通式,由有关实验数据计算推导(用示例训练展示)。概括出来的办法,再通过习题练习应用于新问题的解决,使审题快捷,推算浅易。总结容易见到基本题型,学会基本解法,可以提升剖析和解决综合计算题的能力。综合题是是简单题交叉构成的,审题时第一将它分析、分解为几个简单问题,抓住这几个小题的联系进行求解。假如熟知容易见到题型及一般解法,就能比较顺利地考虑剖析,使问题简单化,依据有关信息的相互联系,通过判断、推理得到解决。容易见到的基本题型,比如过量问题,混合物的组成或反应问题,有关化学式计算等等,对其基本解题方案与方法都要在练习中注意小结总结。 3、练习解题思想办法 各层次能力的形成,要点互联网化、基本解法的练习固然非常重要,但在具体问题中,尤其是能力需要高的选择性计算题、综合计算中总是常识的落脚点非常低,考查的是综合思维能力。综合思维能力仍然是在练习中形成的,这种练习是高层次的,不是盲目做很多综合题就能形成的,教师需要立足于培养化学思想办法上选题,使学生有意识在练习中总结形成科学的思维办法,提升学科能力。科学的思想办法来自于事物本身的变化规律。化学变化的实质是原物质的微粒进行拆分,原子重新组合生成新物质的微粒。化学变化是化分化合过程,物质按肯定微粒数比相互反应遵循守恒定律。比率与守恒就是化分化合过程中量的关系,所以分、合、等、比反映了物质化学变化的方法及对立统一关系,是化学计算的基本原理,同时也是解决化学计算问题的思想办法。在具体化学计算中常常要用到的思想办法主要有:察看法、比较法拆分与重组法、建构模型法、分类讨论法、守恒思想、特殊化与一般化思想、平均化与极端化思想、方程思想、函数思想等。这类办法用于解决对应的化学计算,复杂问题简单化了,解题思路方便快捷了,同时这类办法的形成总是又在解题中获得,由于综合性计算题的设计本身就是熔常识与思维于一体的。 CO、HCOOH、OHCCOOH分别完全燃烧、消耗的O2与生成的CO2的体积比都是1:2,后两者的分子式可以看成是CO(H2O)及(CO)2(H2O)也就是说,只须分子式符合[(CO)n(H2O)m](其中n、m为正整数)的各种有机物完全燃烧时消耗的O2与生成的CO2的体积比一直1:2。现有一些只含C、H、O三种元素的有机物,它们完全燃烧时消耗的O2与生成的CO2的体积比是3:4(上述体积均在相同情况下测定)。那样:这类化合物中相对分子水平最小的化合物的分子式是C2H2O2。在这类有机物中有一种化合物含有两个羧基,取0.2625g该化合物恰好跟25.0mL1mol/LNaOH溶液完全中和,由此可知该化合物的相对分子水平为210并可推导出它的分子式应是C6H10O8。 题示信息给出一种通过重组、综合总结、建构模型的思想办法,第一要学习理解这种办法,然后进行应用解决新问题。本题考查学习新信息、新办法并迁移另一情景中进行应用的能力。建构的模型可以反映一类物质或变化的特征。这种办法在科学研究中有要紧意义。在化学计算中,常见的烃的通式CXHY、通式CnH2n+2等事实上也是这类物质组成的一种模型。用这类通式或依据这类通式书写的有关化学方程式进行计算,能使复杂问题简单化,且能帮助认识某些变化规律,培养思维的深刻性、创造性。 化学计算集技能方法、思维练习于一体,熔智商、能力于一炉,能检验学生应用常识的能力层次,对提升学生学习方法,发展学生思维,进步学生智商,提升解题能力非常有帮助。纵览历年来的高考考试,化学计算的困难程度给大家的感觉是不再难算了,这其实是一种错觉。选择性计算题传统巧解性考试试题已经降低,化学原理、定义等化学素材的呈现落脚点减少了,题目看上好像容易了,但思维素质、思维办法的考查需要提升了,所以题目容易做却难得分,加上大部分学生对入门知识的复习看重不够,越简单题越易失分,所以计算题在高考考试中得分仍然较低。所以大家在复习中预防一味讲巧解忽略入门知识、基本计算办法的练习与总结,预防盲目做综合性计算题,一味强调巧解的经验主义做法。做到夯实基础、重视思维品质的培养两头抓实。 3、《考试说明》中化学计算部分 1、学会有关相对原子水平、相对分子水平及确定分子式的计算。 2、学会有关物质的量的计算。 3、学会有关气体摩尔体积的计算。 4、学会有关物质溶解度的计算。 5、学会有关溶液浓度(溶液中溶质的水平分数和物质的量浓度)的计算。 6、学会有关溶液pH与氢离子浓度、氢氧根离子浓度的简单计算。 7、学会有关燃烧热的计算。 8、学会借助化学方程式的计算。 9、以上化学基本定义和基本理论、容易见到元素单质及其要紧化合物、有机化学基础、化学实验等常识内容中,具备化学原因的各类问题的综合应用。
